Filmes biodegradáveis de gelatina incorporados
com argila bentonita ionicamente modificada
Biodegradable films of gelatin
incorporated with bentonite clay ionically modified
Películas
biodegradables de gelatina incorporada con arcilla bentonita modificada iónicamente
Murillo Alves Garrido1; Ricardo Henrique de Lima Leite2;
Edna Maria Mendes Aroucha3; Francisco Klebson Gomes dos Santos4
1Graduando do curso de Engenharia Química, da
Universidade Federal Rural do Semi-Árido, Mossoró,
Rio Grande do Norte; mugarrido3@gmail.com;
2Professor da Universidade Federal Rural do Semi-Árido,
Mossoró, RN, +558433178200, ricardoleite@ufersa.edu.br; 3Professora
da Universidade Federal Rural do Semi-Árido, Mossoró,
RN, aroucha@ufersa.edu.br; 4Professor da Universidade Federal Rural
do Semi-Árido, Mossoró, RN, klebson@ufersa.edu.br
Recebido:
14/01/2020; Aprovado: 20/02/2021
Resumo: Biofilmes são películas biodegradáveis e/ou
comestíveis elaborados a partir de biopolímeros. A
aplicação de biofilmes como embalagem está diretamente relacionada com suas
características, e com as interações destes com o produto e o ambiente. As
proteínas são materiais promissores, em virtude da ampla gama de propriedades
funcionais. A gelatina é um biomaterial atrativo, devido sua grande produção e
baixo custo. No entanto, a gelatina possui limitações em suas propriedades
físico-químicas quando comparada aos polímeros sintéticos. O melhoramento
destas propriedades foi proposto neste estudo a partir da incorporação de argila
bentonita nos filmes de gelatina. No intuito de aumentar a interação entre a
argila e a gelatina foi realizada modificação da argila na presença de
tensoativo (dodecil sulfato de sódio), visando o
afastamento basal entre as camadas de silicato. Os filmes de gelatina com
argila bentonita modificada foram caracterizados como bionanocompósito
através de análise de Microscopia Óptica, Ângulo de Contato, permeabilidade ao
vapor de água, solubilidade, propriedades mecânicas e umidade. A incorporação
da argila bentonita aos filmes de gelatina reduziu 40,8% da permeabilidade ao
vapor d’água, e aumentou a tensão de ruptura em 55%. A argila melhorou
significativamente as propriedades físico-químicas do filme biopolimérico.
Palavras-chave: Filmes de bionanocompósito; Biopolímero;
Glicerol; Nanocompósitos; Troca iônica.
Abstract: Biofilms are biodegradable and/or edible films made from
biopolymers. The application of biofilms as packaging is directly
related to its characteristics, and to their interactions with the
product and the environment. Proteins are promising materials, due to the wide
range of functional properties. Gelatine is an
attractive biomaterial, due to its large production and low cost. However, gelatine has limitations in its physicochemical properties
when compared to synthetic polymers. The improvement of these properties was
proposed in this study from the incorporation of bentonite clay in the gelatin
films. In order to increase the interaction between
clay and gelatin, clay was modified in the presence of a surfactant (sodium
dodecyl sulfate), aiming at the basal spacing between the silicate layers. The
films of gelatin with modified bentonite clay were characterized as bionanocomposite through analysis of Optical Microscopy
(MO), Angle of Contact (AC), water vapor permeability (PVA), solubility,
mechanical properties and humidity. The incorporation
of bentonite clay into gelatin films reduced 40.8% of the water vapor permeability, and increased the rupture stress by 55%. The
clay significantly improved the physicochemical properties of the biopolymer
film.
Key
words: Bionanocomposite films;
Biopolymer; Glycerol; Nanocomposites; Ion exchange.
Resumen: Las
biopelículas son películas biodegradables y/o comestibles
hechas de biopolímeros. La aplicación de biopelículas como embalaje está
directamente relacionada con sus características y sus interacciones con el
producto y el medio ambiente. Las proteínas son materiales prometedores, debido
a la amplia gama de propiedades funcionales. La gelatina es un biomaterial
atractivo, debido a su gran producción y bajo costo. Sin embargo, la gelatina
tiene limitaciones en sus propiedades fisicoquímicas en comparación con los
polímeros sintéticos. La mejora de estas propiedades se propuso en este estudio
a partir de la incorporación de arcilla de bentonita en las películas de
gelatina. Para aumentar la interacción entre la arcilla y la gelatina, la
arcilla se modificó en presencia de un tensioactivo (dodecil
sulfato de sodio), con el objetivo de la separación basal entre las capas de
silicato. Las películas de gelatina con arcilla de bentonita modificada se
caracterizaron como bionanocompuesto mediante
análisis de microscopía óptica (MO), ángulo de contacto (AC), permeabilidad al
vapor de agua (PVA), solubilidad, propiedades mecánicas y humedad. La
incorporación de arcilla de bentonita en las películas de gelatina redujo el
40.8% de la permeabilidad al vapor de agua y aumentó el estrés de ruptura en un
55%. La arcilla mejoró significativamente las propiedades fisicoquímicas de la
película de biopolímero.
Palabras
Clave: Películas bionanocompuestas;
Biopolímero; Glicerol; Nanocompuestos; Intercambio iónico.
INTRODUÇÃO
A poluição do meio ambiente, causada pelo descarte de embalagens de
matéria-prima não renováveis, é um dos problemas mais graves enfrentado no
mundo. Este é um fato que demanda alternativas para controlar ou eliminar esse
tipo de resíduo, que leva séculos para se decompor. Com esta motivação, surgiu
o interesse em desenvolver biofilmes com propriedades de embalagens
biodegradáveis, que visam reduzir os danos causados pela poluição ambiental e
melhorar a qualidade e durabilidade dos produtos alimentícios (CAETANO et al.,
2018).
A utilização de biofilmes como embalagens para revestimento de frutas e
vegetais ocorre devido os biopolímeros possuírem matrizes biodegradáveis e
serem oriundas de fontes renováveis que reduzem a poluição ambiental causada
por resíduos plásticos (SHANKAR et
al., 2018). Os nanocompósitos biopoliméricos que
utilizam argila como material de enchimento têm sido um foco acadêmico e
industrial nos últimos anos, pois compósitos formados por estes materiais
apresentam melhorias desejadas na barreira de vapor de água, propriedades mecânicas
e térmicas (MONTEIRO et al.,
2017).
O uso de biofilmes tem mostrado grande potencial, baixo custo e
características adequadas para uso em alimentos, atraindo a atenção de muitos
pesquisadores, uma vez que ele fornece uma melhor conservação dos produtos
alimentares. É capaz de prolongar a vida útil destes, porque podem criar uma
barreira semipermeável, contra a água, oxigénio, umidade e movimento de soluto
(PODSHIVALOV et al., 2017;
SORADECH et al., 2017).
Os nanocompósitos de argila podem ser
classificados em três grupos: os convencionais, nos quais as camadas de mineral
agem como um enchimento; os intercalados, onde ocorre a interação da matriz
polimérica de forma regular entre as lamelas do mineral; e o grupo dos
esfoliados onde as camadas do mineral são esfoliadas na matriz polimérica
contínua. (CHEN et al., 2015). A
argila pode ser entendida como um material natural, terroso, de granulação
fina, que quando umedecido com água apresenta características de plasticidade.
Quimicamente são materiais formados por silicatos hidratados de alumínio, ferro
e magnésio, conhecidos como argilominerais (OLIVEIRA et al., 2016).
Nesse contexto, este trabalho teve como objetivo analisar a influência
da argila bentonita modificada com sal quaternário de amônio, nas propriedades
físico-químicas de filmes biodegradáveis de gelatina.
MATERIAL E
MÉTODOS
Foram utilizados três reagentes na composição dos filmes: (1) argila, de
coloração creme claro, em forma de pó, com tamanho médio das partículas de
0,074mm (Armil Mineração do Nordeste); (2) gelatina
bovina em pó incolor e sem sabor (Dr. Oetker do Brasil LTDA); (3) glicerol
P.A–ACS (99,5%) (Dinâmica Química Contemporânea LTDA).
No intuito de tornar a utilização da argila viável na incorporação do
biopolímero, foi realizada uma troca iônica na mesma, utilizando sal
quaternário de amônio, de acordo com metodologia de Li e Guo
(2015). Esse procedimento aumenta o espaçamento basal da estrutura do
argilomineral, modificando sua característica de hidrofílica para organofílica.
Obtenção do
biofilme
Primeiramente foi testado o teor de gelatina para formação dos filmes,
para que os mesmos apresentassem espessuras
equivalentes às encontradas em trabalhos relacionados a filmes para prolongar a
fida de prateleira de frutos e hortaliças. Para tanto, foram preparados quatro
filmes de gelatina, nas concentrações de 2 a 5% (Tabela 1). O teor de glicerol
foi fixado em 30% em relação à massa seca de biopolímero.
|
Tabela 1. Formulação das soluções filmogênicas de gelatina em diferentes concentrações. |
|||
|
Formulação |
Gelatina (g) |
Glicerol (g) |
Água destilada (mL) |
|
F1 |
2 |
0,6 |
97,4 |
|
F2 |
3 |
0,9 |
96,1 |
|
F3 |
4 |
1,2 |
94,8 |
|
F4 |
5 |
1,5 |
93,5 |
|
F1:
Concentração de 2% de gelatina; F2: Concentração de 3% de gelatina; F3:
Concentração de 4% de gelatina; F4: Concentração de 5% de gelatina. Teor de
glicerol fixo, 30% em relação à massa seca de gelatina. |
|||
A preparação de cada solução de gelatina ocorreu com a dispersão da
gelatina no solvente de forma lenta, com um bastão de vidro, visando a não
formação de aglomerados de partículas. Em seguida, a solução foi deixada em repouso,
para que houvesse a solubilização da gelatina a uma temperatura ambiente de 25ºC
por aproximadamente 1 hora, sendo posteriormente aquecida a 60ºC, em um banho
termostático com agitações magnéticas suaves, por 20 minutos.
Foram pesadas 60 g de cada solução filmogênica, e as
mesmas foram moldadas em placas de acrílico com dimensões 15 cm x 15 cm.
As placas foram levadas à estufa, com circulação e renovação de ar a 50ºC, por
6 h.
O filme F4 obtido, de acordo com o procedimento descrito, foi o que obteve
espessura desejável, compatível com os filmes encontrados em outros trabalhos,
e foi denominado como filme controle, FC.
Obtido o teor de gelatina, foram preparadas duas formulações com
diferentes teores de argila, 2,5% e 5% (em relação à massa da gelatina seca) (Tabela
2). As soluções de gelatina e argila foram homogeneizadas em banho ultrassônico
por 30 min, para total solubilização.
|
Tabela 2. Soluções filmogênicas para obtenção dos biofilmes. |
|
|||||
|
Formulação |
Gelatina
em pó (g) |
Glicerol
(g) |
Argila
(g) |
Água
(mL) |
|
|
|
FC |
5 |
1,5 |
- |
93,5 |
|
|
|
FN1 |
5 |
1,5 |
0,125 |
93,37 |
|
|
|
FN2 |
5 |
1,5 |
0,250 |
93,25 |
|
|
|
FC: Filmes controle; FN1: Filme com 2,5% de argila;
FN2: Filme com 5% de argila. |
|||||
A espessura dos filmes foi medida com um auxílio de um micrômetro com resolução de 0,001 mm, em
cinco pontos aleatórios ao longo da extensão de cada um dos filmes.
Determinação das propriedades mecânicas dos filmes
As propriedades mecânicas dos filmes foram obtidas utilizando um a Máquina Universal de Ensaios (que trabalha de acordo
com o método padrão da norma ASTM D882-83, a uma velocidade de ensaio de 5 mm.min-1
com aplicação de força total de 100 KN. As amostras foram avaliadas com o
comprimento de 50 mm x 5 mm de largura, obedecendo a espessura máxima de 0,25 mm.
Determinação da permeabilidade ao vapor de água (PVA)
dos filmes
A PVA foi determinada gravimetricamente, de
acordo com o método padrão ASTM E96-95.
Os filmes foram cortados em forma de discos, com diâmetros de 18 mm, e logo em
seguida depositados no topo das células de medição de PVA. O volume de água foi
de 6 mL, colocado na capsula que fica abaixo do
suporte do filme.
A massa de cada célula foi medida antes de
ser depositada em um dessecador, que continha partículas de sílica em gel no
fundo, proporcionando uma umidade relativa de 10% e temperatura interna de
29ºC. As massas das células foram medidas a cada hora durante um período de 6
horas. A PVA dos filmes foi calculado em g.mm/h.kPa.m²
de acordo com a Equação 1.
|
|
(1) |
Em que: W: peso
da água que permeia através do filme (g); L:
espessura do filme (mm); A: área da
seção transversal ao furo (m²); t: tempo
de permeação (horas); ![]() : diferença de pressão para o vapor de água entre os
dois lados do filme (kPa).
: diferença de pressão para o vapor de água entre os
dois lados do filme (kPa).
Determinação da solubilidade dos filmes
Para caracterizar e coletar os dados da solubilidade dos filmes de
gelatina, utilizou-se a metodologia adaptada de Ge et al. (2015). Para isso, discos (2 cm de diâmetro) dos filmes
foram secos a uma temperatura de 105°C por 60 minutos em uma estufa; as amostras
foram submersas em água destilada, em agitação por 24 h, utilizando uma mesa
agitadora a 200 rpm; posteriormente os discos foram secos mais uma vez a 105°C
por 60 minutos. A solubilidade foi calculada partir a partir da Equação 2.
|
|
(2) |
Em que: mi:
massa inicial (g); mf: massa final (g)
Determinação da umidade dos filmes
Para se determinar a umidade dos filmes foram cortadas amostras com
dimensões de 2 cm x 2 cm, e pesados em uma balança analítica de precisão
(AY220, MASTER®). Logo em seguida, as amostras dos filmes foram
secas a 105ºC por 1 h. Após a secagem, os filmes foram imediatamente pesados. Foi
obtido o valor percentual da umidade pela Equação 3.
|
|
(3) |
Em que: mi:
massa inicial (g); mf: massa final (g)
Determinação da opacidade dos filmes
A opacidade dos filmes foi determinada pelo colorímetro
(modelo CR 10, Minolta), calibrado com fundo branco e
preto padrões (Fakhouri
et al., 2015). Os valores de
opacidade foram calculados de acordo com a Equação 4.
|
|
(4) |
Em que, Opp é a opacidade do filme contra um fundo preto
e Opb
é a opacidade do filme contra um fundo branco.
Análise morfológica dos filmes
A fim de evidenciar a barreira que o material de reforço (argila
bentonita) proporciona ao logo da matriz de argila, foi analisada a superfície
dos filmes por meio de micrografias feitas em microscópio óptico de transmissão
(Olympus BX52, equipado com uma câmara Olympus C5050Z). Obtiveram-se
micrografias ópticas para cada filme, utilizando o modo de luz incidente. As
amostras foram cuidadosamente vertidas em suporte de alumina e espalhada sob
cobertura de vidro, à temperatura ambiente, antes das observações.
Determinação do ângulo de contato dos filmes
O ângulo de contato (θ) ou de
molhabilidade corresponde ao valor, em graus, que uma
determinada substância líquida forma com a superfície, como por exemplo, uma
gota de água sobre a superfície da amostra. Os resultados dos ângulos de
contato dependem da constituição de cada material, do solvente, da rugosidade
do filme, e outras características (Silva et al., 2007).
Para caracterizar a afinidade da gelatina em interagir com um meio
polar antes e depois da adição de argila bentonita, foi investigado o ângulo de
contato da gota d’água sobre a superfície do filme. Todos os ensaios foram
realizados em triplicata.
RESULTADOS E DISCUSSÃO
A Tabela 3 apresenta o resultado de espessura do filme de gelatina (FC)
e os filmes de gelatina e argila (FN1 e FN2). No qual o FC teve uma espessura
média de 0,185 mm, o FN1 0,174 mm e o FN2 0,190 mm.
Percebem-se, na Tabela 3, desvios padrões relativamente baixos, o que
demostra homogeneidade dos filmes formados, apesar do método casting ser de difícil controle. A
espessura é um indicador que afeta as propriedades físico-químicas dos filmes,
e quando controlada permite a uniformidade do material e a validade das
comparações entre suas propriedades (VICENTINO et al., 2011).
|
Tabela 3. Espessura dos filmes biodegradáveis
de gelatina incorporados com argila bentonita ionicamente
modificada |
||
|
Amostra |
Composição |
Espessura (mm) |
|
FC |
Gelatina +
glicerol + água |
0,185 ± 0,014 |
|
FN1 |
Gelatina +
glicerol + água + argila bentonita (2,5%) |
0,174 ± 0,018 |
|
FN2 |
Gelatina +
glicerol + água + argila bentonita (5%) |
0,190 ± 0,044 |
|
FC:
Filme controle; FN1: Filme com 2,5% de argila; FN2: Filme com 5% de argila. |
||
Esse parâmetro pode variar de acordo com os componentes agregados aos
filmes ou diferentes volumes de solução filmogênica adicionada às placas para a
elaboração dos filmes. Lucena et al.
(2017) obtiveram filmes com espessuras variando entre 0,14 e 0,21 mm em filmes
de gelatina, glicerol e xiloglucana; esses valores
encontram-se na mesma faixa dos filmes obtidos nesse trabalho (0,17 a 0,19 mm).
Na Tabela 4 são apresentados os resultados de solubilidade e umidade
dos filmes, os quais o filme controle teve uma solubilidade de 96%, o filme FN1
95% e o filme FN2 92%. Nota-se que a incorporação dos argilominerais aos filmes
resultou numa redução da porcentagem de material seco solubilizado e da
umidade, em relação ao filme controle, sugerindo que a carga incorporada a
matriz polimérica contribuiu para que houvesse um aumento na resistência à
solubilidade em água do material.
O tratamento aniônico causou a redução da solubilidade, possivelmente
devido ao tipo de grupos amino, o que tornou os filmes mais hidrofóbicos, de
acordo com a quantidade disposta em cada sal quaternário e, de acordo com Huang
e colaboradores (2005), um maior número desses grupos afeta a diminuição da
solubilidade.
|
Tabela 4. Solubilidade e umidade dos filmes
biodegradáveis de gelatina incorporados com argila bentonita ionicamente modificada |
||
|
Amostra |
Solubilidade (%)
|
Umidade (%) |
|
Controle |
96 ± 0,007 |
16 ± 0,004 |
|
FN1 |
95 ± 0,009 |
13 ± 0,007 |
|
FN2 |
92 ± 0,009 |
12 ± 0,001 |
|
FC:
Filme controle; FN1: Filme com 2,5% de argila; FN2: Filme com 5% de argila. |
||
Outra hipótese para o aumento da hidrofobicidade do filme explicada por
Santos (2014) está relacionada à retenção de umidade do meio pelo mineral, que
além de dificultar a hidratação da matriz hidrofílica, previne a ocorrência de
processos difusivos, devido à interação entre a argila e o biopolímero.
Monteiro et
al. (2017), evidenciaram uma redução na solubilidade dos filmes devido
ao volume da matriz de biopolímero reduzir pela interação do material de
enchimento durante a formação do nanocompósito.
A Figura 1 apresenta os parâmetros obtidos nos ensaios mecânicos dos
filmes, como a ruptura e elasticidade e a deformação de cada filme elaborado
nesse estudo. Pode-se observar que o filme controle obteve a maior deformação
(DF), 91mm, porém, suportou a menor tensão de ruptura (TR), 9,5 KPa. Com a
adição do argilomineral os filmes aumentaram a tensão enquanto diminuía a
deformação. O FN2, apresentou a maior TR, 21,8 KPa, enquanto sua deformação máxima
foi de 27 mm. Segundo Yu et al.
(2006), essas diferenças nas propriedades mecânicas, pela adição de argila, são
devido às ligações de hidrogênio formadas entre a argila e o biopolímero.
A Figura 2 apresenta os resultados de permeabilidade ao vapor d’água para
os três filmes. Pode-se perceber que os valores da PVA diminuíram à medida que
se acrescentava argila na matriz, chegando a uma redução de 40,8%. De acordo
com ZHAO et al., (2017) filmes
de bionanocompósitos apresentam características
melhoradas em relação ao biofilme original, já que os argilominerais são
dispersados pela matriz polimérica, proporcionando um caráter de barreira.
Figura 1. Curva de tensão versus deformação dos filmes de gelatina: controle
(FC), e com adição de argila nas concentrações de 2,5% e 5%, FN1 e FN2, respectivamente.

Figura 2. Permeabilidade ao vapor d’água (PVA) dos filmes elaborados a partir de gelatina
e gelatina com argila (FC: Filmes controle; FN1: Filme com 2,5% de argila; FN2:
Filme com 5% de argila).

A Figura 3 apresenta os valores de ângulo de contato dos filmes
elaborados a parti de gelatina e gelatina com argila. Pode-se verificar um
ângulo de 32º formado entre a gota d’água e o filme controle de gelatina,
evidenciando a tendência que a gelatina tem de interagir com o meio polar.
O uso da argila bentonita modificada como material de reforço em um
teor de 5% (FN2) obteve o maior ângulo de contato, aumentando em 50% com
relação ao filme controle. Pode-se afirmar que essa interação está relacionada
com a compatibilidade eletrostática entre a gelatina e a argila modificada, de forma
que quanto maior os grupos funcionais do modificador orgânico, maior é o espaço
entre as camadas de silicato que a estrutura polimérica encontra para se
entrelaçar, estabelecendo ligações intermoleculares com tais grupos funcionais
(CRÉTOIS et al., 2014).
Portanto, as camadas de silicato se dispersam uniformemente ao longo da
estrutura da gelatina reduzindo a capacidade desta de realizar ligações de
hidrogênio com o meio.
Figura 3. Ângulo de contato da gota d’água sobre os filmes biodegradáveis (FC: Filme
controle; FN1: Filme com 2,5% de argila; FN2: Filme com 5% de argila).

Os filmes devem apresentar opacidade
e coloração atrativas e que não se modifiquem com o passar do tempo, para que a
aceitação do produto não seja prejudicada pelo tempo de armazenamento (RUIZ-HITZKY
et al., 2013). Os resultados da
adição e consequentemente do aumento do teor de argila bentonita nos filmes de
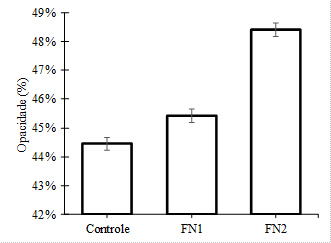
gelatina sobre os valores da opacidade são ilustrados na Figura 4.
A passagem de luz nos filmes de
gelatina diminuiu com a presença da argila. O valor da opacidade do filme
controle teve uma diferença significante quando comparado com o FN2. O filme
controle mostrou 44,5% de opacidade, sendo esta aumentada para 45,4% e 48,4%
nos teores de 2,5% e 5%, respectivamente. Segundo Giannakas
et al. (2014), a maior redução na transmissão de luz dos filmes de nanocompósitos em relação ao filme controle sugere que a
argila não foi completamente dispersa, por formar aglomerações intercaladas na
matriz do biopolímero, impedindo a passagem de luz através da película.
Figura 4. Opacidade dos filmes biodegradáveis de
gelatina incorporados com argila bentonita ionicamente
modificada (FC: Filmes controle; FN1: Filme com 2,5% de argila; FN2: C).
A Figura 5 detalha as micrografias ópticas dos filmes (FC: Filmes
controle; FN1: Filme com 2,5% de argila; FN2: Filme com 5% de argila). Analisando
as micrografias percebe-se uma alteração na morfologia das superfícies dos
filmes de gelatina com o conteúdo de reforço. Nas micrografias das Figura 5 (b)
e (c) que são os FN1 e FN2, respetivamente, observou-se a presença de cristais
maiores que os grânulos de gelatina, devido à presença do material de reforço
(CYRAS et al., 2008). Na Figura
5 (c), é possível observar a dispersão das camadas de silicato, evidenciando o
maior grau de esfoliação, quando comparada com a Figura 5 (a) e (b). Esses
resultados explicam os melhores resultados do FN2 em relação ao FN1, sobre as
propriedades físico-químicas de filmes biodegradáveis que também são observadas
em outros estudos tais como o de Shah et
al. (2016).
Figura 5. Micrografias ópticas dos
filmes biodegradáveis de gelatina incorporados com argila bentonita ionicamente modificada (a) Controle, (b) FN1 (Filme com
2,5% de argila) e (c) FN2 (Filme com 2,5% de argila).

CONCLUSÕES
A incorporação de argila favorece as propriedades de barreira, com
melhoria e diminuição considerável da permeação de vapor de água dos filmes de
gelatina. As propriedades mecânicas dos filmes são influenciadas pelo teor de
argila incorporada, aumentando a tensão na ruptura e reduzindo a deformação dos
filmes.
AGRADECIMENTOS
Os autores agradecem à Universidade Federal Rural do Semi-Árido (UFERSA) por todo suporte no desenvolvimento do
trabalho.
REFERÊNCIAS
CAETANO,
K. S.; LOPES, N. A.; COSTA, T. M.; BRANDELLI, A.; RODRIGUES, E.; FLÔRES, S. H.;
OLIVEIRA, F. C. Characterization of
active biodegradable films based on
cassava starch and natural compounds. Food Packaging and Shelf Life, v. 16, p. 138-147,
2018. 10.1016/j.fpsl.2018.03.006.
CHEN, J. H.; YANG, M. C. Preparation and characterization of nanocomposite of maleated poly (butylene adipate-co-terephthalate) with
organoclay. Materials Science and Engineering: C, v. 46, p. 301-308, 2015. 10.1016/j.msec.2014.10.045.
CRÉTOIS, R.; FOLLAIN, N.;
DARGENT, E.; SOULESTIN, J.; BOURBIGOT, S.; MARAIS, S.; LEBRUN, L. Microstructure and barrier properties of PHBV/organoclays bionanocomposites. Journal of Membrane Science, v. 467, p.
56-66, 2014. 10.1016/j.memsci.2014.05.015.
CYRAS, V. P.; MANFREDI, L. B.;
MINH-TAN, T. T.; VAZQUEZ, A. Physixal
and mechanical properties of thermoplastic starch/montmorillonite nanocomposite
films. Carbohydrate Polymers, v. 73, p. 55-63,
2008. 10.1016/j.carbpol.2007.11.014.
FAKHOURI, F. M.; MARTELLI, S.
M.; CAON, T.; VELASCO, J. I.; MEI, L. H. I. Edible films and coatings based on
starch/gelatin: Film properties and effect of coatings on quality of refrigerated
Red Crimson grapes. Postharvest Biology and
Technology, v. 109, p. 57-64, 2015. 10.1016/j.postharvbio.2015.05.015.
GE, L.; LI, X.; ZHANG, R.;
YANG, T.; YE, X.; LI, D.; MU, C. Development and
characterization of dialdehyde xanthan gum crosslinked gelatin based edible
films incorporated with amino-functionalized montmorillonite. Food Hydrocolloids, v. 51,
p. 129 – 135, 2015. 10.1016/j.foodhyd.2015.04.029.
GIANNAKAS, A.; GRIGORIADI, K.;
LEONTIOU, A.; BARKOULA, N. M.; LADAVOS, A. Preparation, characterization,
mechanical and barrier properties investigation of chitosan-clay
nanocomposites. Carbohydrate Polymers, v. 108, p.
103-111, 2014. 10.1016/j.carbpol.2014.03.019.
HUANG, M. F.; YU, J. G.; MA,
X. F.; JIN, P. High performance biodegradable thermoplastic starch—EMMT nanoplastics. Polymer,
v. 46, n. 9, p. 3157-3162, 2005. 10.1016/j.polymer.2005.01.090.
LI, M.; GUO, Q. The
preparation of the hydrotalcite-based composite phase change Material. Applied
Energy, v. 156, p. 207-2012, 2015. 10.1016/j.apenergy.2015.07.040.
MONTEIRO, M. K. S.; OLIVEIRA,
V. R. L.; SANTOS, F. K. G.; LEITE, R. H. L..; AROUCHA, E. M. M.; SILVA, R. R.;
SILVA, K. N. O. Analysis of Water Barrier, Mechanical and Thermal Properties of
Nanocoposites Based on Cassava Starch and Natural
Clay or Modified by Anionic Exchange. Materials
Research, v. 20, supl. 2, 2017. 10.1590/1980-5373-mr-2016-1087.
OLIVEIRA, C. I. R.; ROCHA, M.
C. G.; SILVA, A. L. N. BERTOLINO, L. C.
Characterization of betonite clays from cubati, Paraíba (Northeast of
Brazil). Cerâmica, v. 62, p. 272-277,
2016. 10.1590/0366-69132016623631970.
OLIVEIRA, V. R. L.; XAVIER, T.
D. N.; ARAÚJO, N. O. ALMEIDA, J. G. L.; AROUCHA, E. M. M.; SANTOS F. K. G.;
LEITE, R. H. L.; SILVA, K. N. O. Evaluation of Biopolimeric
Films of Cassava Starch with Incorporation of Clay Modified by Ionic Exchange and its Application as a Coating in a Fruit. Materials Research, v. 20, 2018. 10.1590/1980-5373-mr-2016-0928.
PASSOS,
E. F. Síntese e caracterização de filmes a base de amido e glicerol com adição
de argilominerais. 2015. 56 f. Trabalho de Conclusão de Curso (Bacharel em
Química), Universidade Tecnológica Federal do Paraná. Pato Branco. 2015.
PODSHIVALOV, A.; ZAKHAROVA, M.
GLAZACHEVA, E.; USPENSKAYA, M. Gelatin/potato starch edible biocomposite
films: Correlation between morphology and physical properties. Carbohydrate polymers, v. 157, p. 1162-1172,
2017. 10.1016/j.carbpol.2016.10.079.
RUIZ-HITZKY,
E.; DARDER, M.; FERNANDES, F. M.; WICKLEIN, B.; ALCÂNTARA, A. C. S.; ARANDA, P.
Fibrous clays based bionanocomposites. Progress in
Polymer Science, v. 38, p. 1392-1414, 2013. 10.1016/j.progpolymsci.2013.05.004.
SANTOS,
W. J. Desenvolvimento e caracterização de filmes nanocompósitos
de araruta (Maranta arundinacea)
e montmorillonita. 2014. 79 f. Dissertação
(Mestrado) - Curso de Engenharia Química, Universidade Federal da Bahia, Salvador-BA, 2014.
SAURABH, C. K.; GUPTA, S.;
BAHADUR, J.; MAZUMDER, S.; VARIYAR, P. S.; SHARMA, A. Mechanical and barrier
properties of guar gum based nanocomposite films. Carbohydrate
Polymers. v. 124, p. 77-84, 2015. 10.1016/j.carbpol.2015.02.004.
SHAH, K. J.; SHUKLA, A. D.;
SHAH, D. O.; IMAE, T. Effect of organic modifiers on dispersion of ornoclay in polymer nanocomposites to improve mechanical
properties. Polymer, v. 97, p. 525-532, 2016. 10.1016/j.polymer.2016.05.066.
SHANKAR, S.; RHIM, J. Bionanocomposite films for food packaging applications. Reference
Module in Food Science, v. 45, p. 264-271, 2018. 10.1016/B978-0-08-100596-5.21875-1.
SILVA,
W. A.; PEREIRA, J.; CARVALHO, C. W. P.; FERRUA, F. Q. Determinação da cor,
imagem superficial topográfica e ângulo de contato de filmes de diferentes
fontes de amido. Ciência Agrotécnica, v. 31, p.
154-163, 2007. 10.1590/S1413-70542007000100023.
SORADECH, S.; NUNTHANID, J.;
LIMMMATVAPIRAT, S.; ANAN, M. L. Utilization of shellac and gelatin composite
film for coating to extend the shelf life of banana. Food Control, v. 73, p.
1310-1317, 2017. 10.1016/j.foodcont.2016.10.059.
VICENTINO,
S. L.; FLORIANO, P. A.; DRAGUNSKI, D. C.; CAETANO, J. Filmes de amidos de
mandioca modificados para recobrimento e conservação de uvas. Química Nova, v. 34, p.
1309- 1314, 2011. 10.1590/S0100-40422011000800003.
YU, L.; DEAN, K.; LI, L.
Polymers blends and composites from renewable resources. Progress in polymer
Science. v. 31, p. 576-602, 2006. 10.1016/j.progpolymsci.2006.03.002.
ZHAO, Q.; CHOO, H.; BHATT, A.;
BURNS, S. E.; BATE, B. Review of the fundamental geochemical and physical
behaviors of organoclay in barrier applications. Applied Clay Science, v. 142, p. 2-20, 2017. 10.1016/j.clay.2016.11.024